Как вода может превращаться в суперкислоту и рождать алмазы? Экстремальное давление открывает неожиданные свойства H₂O
Вода. Основа жизни, самая привычная жидкость на Земле. Мы пьем её, купаемся в ней, она покрывает большую часть нашей планеты. Кажется, что мы знаем о ней всё, правда? А вот и нет. Недавние исследования показывают: в экстремальных условиях наша старая знакомая H₂O способна на такие фокусы, что и представить сложно. Представьте себе воду, которая становится злее самой концентрированной серной кислоты. Звучит как научная фантастика? Давайте разбираться.
Когда вода выходит из себя
Учёные из Университета Сорбонны и французского CNRS (Национального центра научных исследований) при помощи компьютерного моделирования заглянули в мир, где царят поистине адские условия. Речь идёт о температурах, сравнимых с солнечными пятнами (от 1700 до 2700 °C), и давлениях, которые сложно вообразить — десятки гигапаскалей. Это примерно как если бы на кончик вашего пальца давил вес сотен взрослых слонов (хотя, честно говоря, такое сравнение лишь царапает поверхность реальности этих давлений).

И вот тут-то и происходит самое интересное. Оказывается, в таких нечеловеческих условиях молекулы воды начинают вести себя совершенно иначе. Они активно обмениваются протонами (ионами водорода), и вода превращается… в суперкислоту. Насколько супер? По оценкам исследователей, Флавио Сиро Бриджиано и его коллег, такая вода может быть в миллиарды, а то и триллионы (!) раз агрессивнее серной кислоты. Да-да, та самая водичка, которой мы поливаем цветы.
Чтобы прийти к таким выводам, команда использовала мощные компьютерные симуляции, отслеживающие поведение каждого атома. А чтобы ускорить процесс и провести больше расчётов, они подключили к делу ещё и машинное обучение. Умные алгоритмы помогли предсказать поведение системы в разных сценариях, не тратя месяцы на вычисления.
Алмазный дождь — уже не миф?
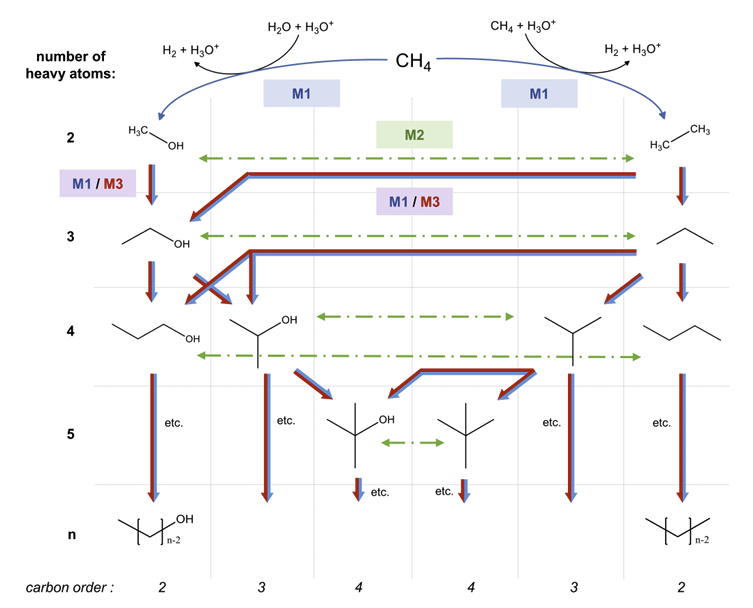
Но зачем воде становиться таким кислотным монстром? И что это значит для нас или для Вселенной? А вот тут начинается самое захватывающее. Моделирование показало ещё кое-что любопытное. Эта суперкислотная вода способна вступать в реакцию с простыми углеводородами, вроде метана (CH₄), который в избытке встречается на ледяных гигантах нашей Солнечной системы.
И что же происходит при этой реакции? Суперкислотная вода буквально «отрывает» у метана атомы, заставляя углерод перестраиваться. В результате могут образовываться сложные структуры, очень похожие на алмазы! В частности, упоминается образование иона метания (CH₅⁺) — частицы, которую уже наблюдали в других суперкислотных средах.
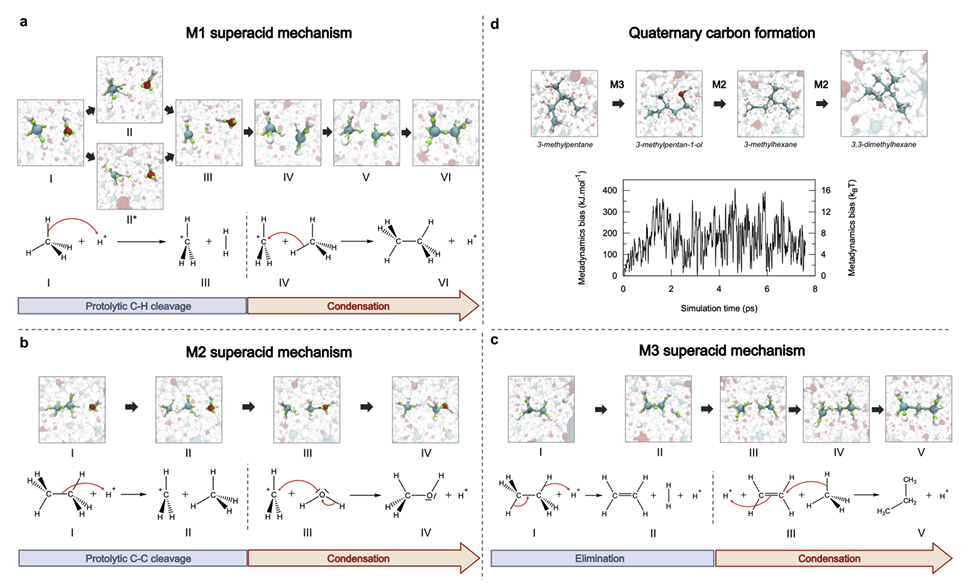
Помните разговоры про алмазные дожди на Уране и Нептуне? Долгое время это считалось красивой гипотезой. Но работа французских учёных подливает масла в огонь! Как предполагает соавтор исследования Артур Франс-Ланор, именно этот механизм — превращение метана под действием суперкислотной воды — может быть ключом к разгадке тайны алмазных осадков на далёких планетах. Представляете? Целые ливни из драгоценных камней, рождённые из воды и газа под чудовищным давлением.
А нам-то что с этого?
Хорошо, с Ураном и Нептуном понятно. А есть ли от этого открытия какая-то практическая польза здесь, на Земле? Ну, пока что говорить о конкретике рано. Воссоздать условия недр ледяных гигантов в лаборатории — задача, мягко говоря, нетривиальная.
Однако перспективы интригуют. Если удастся найти способ управлять этим процессом при чуть менее экстремальных (хотя всё равно весьма суровых) параметрах, это может открыть дорогу к новым методам синтеза алмазов. Кто знает, может, в будущем ювелирные украшения будут делать с помощью «рассерженной» воды?
Кроме того, суперкислоты активно применяются в промышленности, например, при переработке нефти. Возможно, суперкислотная вода когда-нибудь сможет заменить существующие, часто опасные и дорогие, промышленные кислоты. Звучит заманчиво, не правда ли?
Не всё так просто…
Конечно, пока это больше похоже на смелые мечты. Как справедливо замечают скептики, вроде Джоэла Боумана из Университета Эмори, главная загвоздка — именно в экстремальных условиях. Добиться их стабильно и безопасно в промышленных масштабах — огромный вызов. Да и связь с алмазными дождями пока остаётся красивой, но всё же гипотезой, требующей подтверждений.
Что дальше? Учёные не сидят сложа руки. Следующий логичный шаг — попытаться подтвердить эти сумасшедшие свойства воды экспериментально. Франс-Ланор и его команда уже ищут способы провести такие опыты в лаборатории, возможно, при более низких давлениях и температурах. Если им это удастся, то и практическое применение этой удивительной химии воды станет чуточку ближе.
Так что в следующий раз, наливая стакан воды, задумайтесь. Эта простая на вид жидкость хранит в себе ещё массу тайн. И кто знает, какие ещё сюрпризы она нам преподнесёт, когда мы заглянем поглубже в её природу, особенно под давлением. Наука тем и прекрасна, что постоянно показывает нам: даже самые привычные вещи могут быть невероятно сложными и удивительными.